2025年3月28日 ,阿法纳生物与中国科学技术大学王育才教授团队合作,《Nature Biomedical Engineering》上发表题为" Generation of tolerogenic antigen-presenting cells in vivo via the delivery of mRNA encoding PDL1 within lipid nanoparticles "的研究论文。

研究先是以Moderna COVID-19 mRNA疫苗的LNP配方为参考,根据田口正交阵列设计创建9种LNP配方,通过艾特森MPE-L2型微流控设备仪完成样品制备,为后续小鼠皮下给药、不同配方免疫原性评估及低免疫原性配方筛选提供了精准的实验制备支撑,是实现低免疫原性LNPs配方优化与验证的关键实验环节。

研究背景
文献中创新性地构建了低免疫原性脂质纳米颗粒(LNPs)递送PD-L1 mRNA,在体内直接编程生成耐受性抗原呈递细胞(tol-APCs),在类风湿性关节炎与溃疡性结肠炎等自身免疫病模型中展现出疗效,实现无需体外细胞操作、直接在体内构建功能性tol-APCs的治疗策略。该策略不仅能选择性抑制致病性T细胞活化,还能扩大调节性T细胞(Tregs)群体,真正实现“精准抑制病灶、重建免疫耐受”的自免治疗新机制,具有很强的疾病特异性和长期疗效潜力。
1. 核心概念与机制框架
针对传统tol-APCs 体外制备的复杂性,研究团队提出 “低免疫原性mRNA递送+体内原位生成tol-APCs”的核心策略,同时明确其治疗机制:tol-APCs通过PDL1/PD1通路,选择性靶向高表达PD1的激活T细胞(诱导其凋亡、抑制其增殖),并促进调节性T细胞(Treg)扩增,且不影响低表达PD1的初始T细胞,为后续实验设计奠定明确方向。

图例1:核心概念与机制框架
2. 实验过程
➤ 通过 Design of Experiments 选择低免疫原性的LNPs

图例2:配方筛选
通过艾特森MPE-L2微流控设备制备样品后,对小鼠皮下给药,评估不同配方的免疫原性,结果中发现脂质组成(摩尔比)和N/P比均对LNPs的转染效率和免疫原性有显著影响,在9组中选取低免疫原性的配方,以避免在AIDs治疗中引发意外的免疫反应。
➤ 低免疫原性LNPs/mPDL1制备工艺条件

图例3:LNPs/mPDL1制备过程
➤ 制备包载PDL1 mRNA的LNPs

3. 低免疫原性LNPs的筛选优化
基于图例1对载体的低免疫原性需求,图例4通过实验设计(DOE)完成载体筛选,以EGFP mRNA为报告基因,检测淋巴结树突状细胞(DCs)的共刺激分子(CD80、CD86、CD40)表达,最终筛选出A7配方(SM-102:DSPC:DMG-PEG2000: 胆固醇=25:5:0.5:69.5,N/P=4),其共刺激分子表达最低,为mRNA递送提供理想载体。
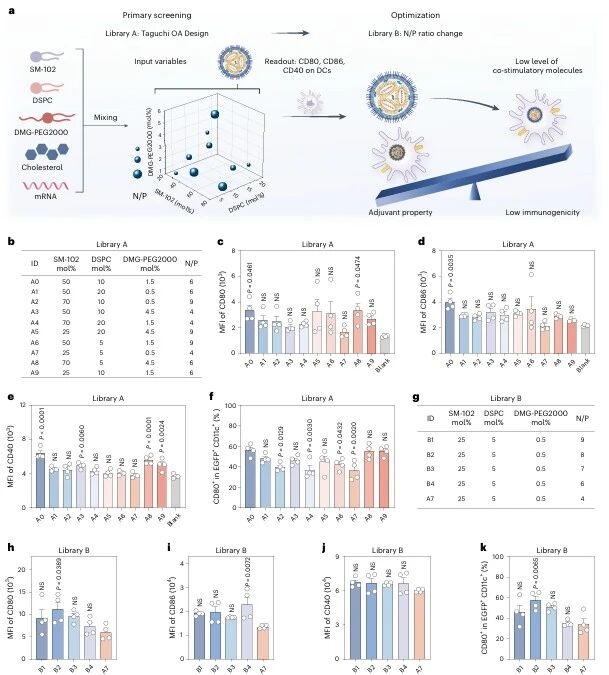
图例4:低免疫原性LNPs的筛选优化
4.LNPs/mPDL1体内外生成tol-APCs
载体优化后,研究团队验证核心功能:体外实验中,DC2.4和RAW264.7细胞经LNPs/mPDL1处理后,表面 PDL1表达显著升高;体内实验中,小鼠皮下注射LNPs/mPDL1 后,淋巴结、脾脏、外周血中的CD11c +和 CD11b+ APC 高表达PD1,骨髓中无tol-APCs 生成,且 tol-APCs可持续存在至少4天,该方法仅靶向APC,对非APC免疫细胞影响极小。
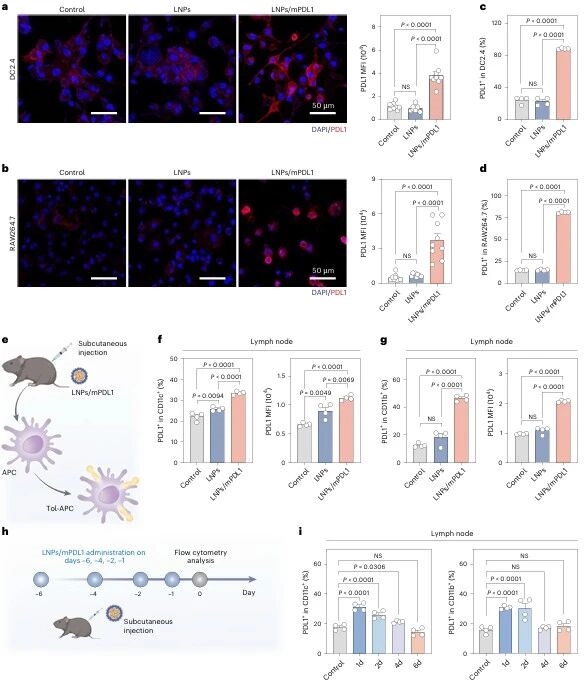
图例5:LNPs/mPDL1体内外生成tol-APCs
5.tol-APCs对激活T细胞的体外调控
为验证tol-APCs的调控功能,研究团队开展体外实验:激活的T细胞高表达PD1,与LNPs/mPDL1诱导的tol-APCs共培养后,CD4+和 CD8+T细胞增殖显著受抑,且tol-APCs可诱导激活T细胞凋亡,不影响初始T细胞,激活T细胞caspase-3/7活性增强,佐证凋亡通路参与调控。

图例6:tol-APCs对激活T细胞的体外调控
6.tol-APCs对激活T细胞的体内选择性清除
体外机制明确后,研究团队通过过继转移实验验证体内效果:用CFSE标记区分激活T 细胞(高CFSE)和初始T细胞(低CFSE),输注给预先注射LNPs/mPDL1的裸鼠,结果显示LNPs/mPDL1处理组中,激活T细胞占比、激活/初始T细胞比值显著降低,CD4+和CD8+激活T细胞被选择性清除,初始T细胞比例升高,验证了治疗的安全性和特异性。

图例7:tol-APCs对激活T细胞的体内选择性清除
7.RA模型中tol-APCs的治疗效果
机制验证完成后,研究团队将策略应用于类风湿关节炎(RA)模型:DBA/1小鼠经Ⅱ型胶原蛋白免疫诱导RA,给予LNPs/mPDL1、空LNPs、依那西普(临床RA治疗药物)或PBS处理,结果显示LNPs/mPDL1组关节炎指数、爪垫肿胀程度显著降低,关节软骨损伤减轻,炎症因子(IFN-γ、TNF-α)水平降低,淋巴结中促炎CD4+T细胞减少、Treg细胞增多,疗效与依那西普相当。
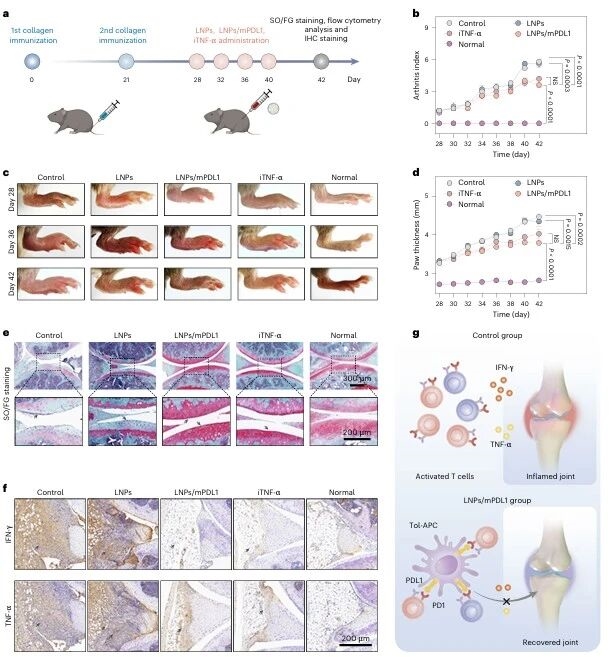
图例8:RA模型中tol-APCs的治疗效果
8.UC模型中tol-APCs的治疗效果
为证明策略普适性,研究团队将其拓展至溃疡性结肠炎(UC)模型:C57BL/6小鼠饮用3%DSS水溶液诱导UC,给予LNPs/mPDL1、空LNPs、环孢素(临床UC治疗药物)或PBS处理,结果显示 LNPs/mPDL1组疾病活动指数(DAI)降低,体重下降和结肠缩短现象改善,肠道黏膜损伤减轻,肠系膜淋巴结中Th17细胞减少、Treg细胞增多,疗效与环孢素相当。
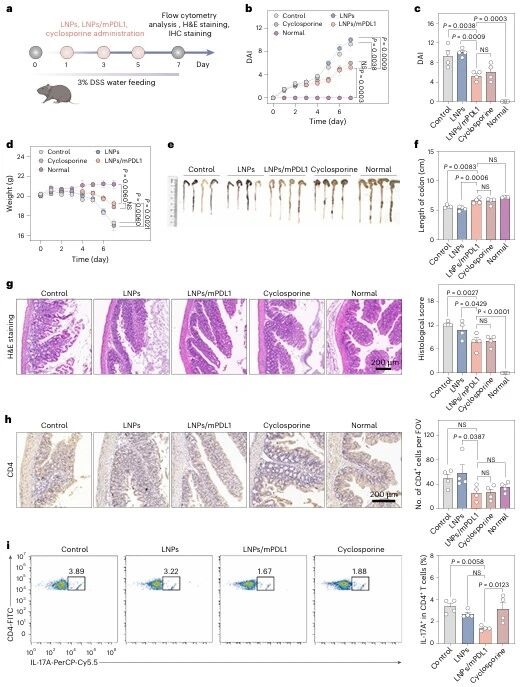
图例9:UC模型中tol-APCs的治疗效果
知识分享:研究亮点
1 低免疫原性脂质纳米粒(LNPs)设计:通过优化脂质成分及氮磷比(N/P),开发出低免疫原性的LNPs/mPDL1递送系统,显著减少APC表面共刺激分子(如CD80、CD86、CD40)的表达,避免传统LNPs的佐剂效应,从而抑制非特异性免疫激活;
2 体内原位生成致耐受性APCs:利用mRNA技术,通过皮下注射LNPs/mPDL1,直接在体内诱导APCs高表达PDL1,生成tol-APCs,选择性靶向活化的PD1和 T细胞并诱导其凋亡,同时保留初始T细胞;
3 广谱治疗潜力与临床转化优势:在类风湿性关节炎(RA)和溃疡性结肠炎(UC)小鼠模型中,LNPs/mPDL1显著缓解炎症、减少致病性Th1/Th17细胞、增加调节性T细胞(Treg),疗效媲美临床药物(如依那西普、环孢素),为自身免疫病及器官移植耐受提供了新策略。
参考文献:
Nature Biomedical Engineering ( IF 26.8 ) Pub Date:2025-03-28,DOI: 10.1038/s41551-025-01373-0.
 欢迎来到苏州艾特森制药设备有限公司网站!
欢迎来到苏州艾特森制药设备有限公司网站! 欢迎来到苏州艾特森制药设备有限公司网站!
欢迎来到苏州艾特森制药设备有限公司网站!










