2025年1月30日 ,医药先进制造国家工程研究中心何军团队在《Nano Today》上发表了题为" Designed microchannel-based lipid nanoparticles encapsulated siRNA targeting gasdermin D for sepsis management via pulmonary delivery "的学术论文。

研究团队自主设计的 “CA/SAR型集成芯片”(CA/SAR/C1),通过艾特森微流控制备仪MPE-L2实现了制备靶向Gasdermin D(GSDMD)的siRNA脂质纳米颗粒(siGSDMD-LNPs)的连续、可控、高效制备,该纳米粒在LPS诱导的脓毒症小鼠中展现出显著的治疗效果,为探索脓毒症治疗新策略提供了重要参考。

研究背景
脓毒症是一种由感染引发的失控性宿主反应失调,导致致命性器官功能障碍。该病死亡率高达40%,目前缺乏获批的有效治疗药物。
Gasdermin D(GSDMD)属Gasdermin蛋白家族,抑制GSDMD可阻断炎症细胞焦亡、减轻脓毒症症状;小干扰RNA(siRNA)具有靶向特异性强、沉默效率高的优势;脂质纳米粒(LNPs)是siRNA的理想非病毒递送载体。
1. siGSDMD-LNPs的制备流程及脓毒症缓解机制示意图
研究团队清晰展示基于CA/SAR/C1微通道的siGSDMD-LNPs制备工艺,明确了脂质组分、缓冲体系以及微流控混合稀释的完整流程。
而该纳米粒缓解脓毒症的机制在于:siGSDMD经LNPs递送后,能够沉默GSDMD基因,抑制GSDMD蛋白的切割以及膜孔形成,进而阻断细胞焦亡、炎症因子释放和器官损伤,最终达到缓解脓毒症的效果。
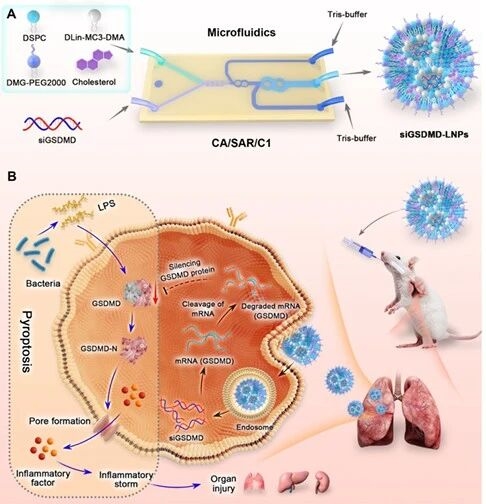
图例1:siGSDMD-LNPs的制备流程及脓毒症缓解机制示意图
2. 制备过程
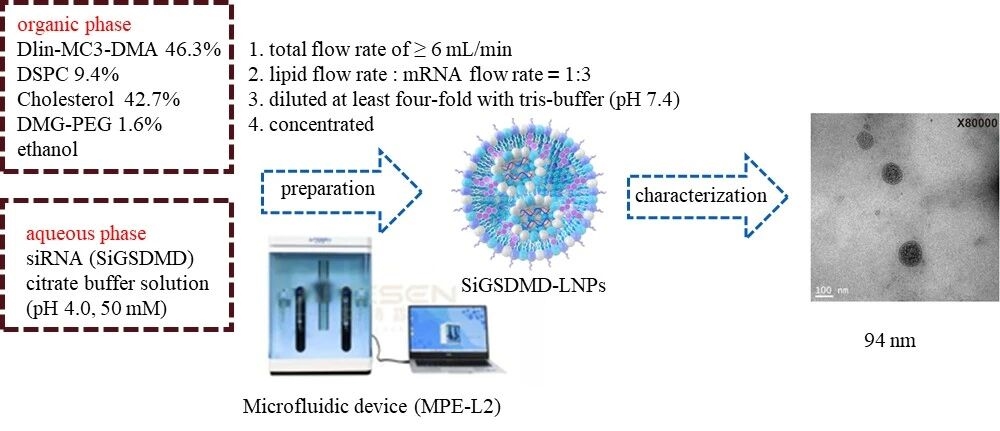
图例2:siGSDMD-LNPs制备过程
3. CA/SAR微通道和CA/SAR/C1生产质量稳定的LNP的扩展策略
展示从微通道设计到LNPs连续生产的技术路径,整合圆形不对称分裂-重组混合原理,通过多入口协同进料实现流体精准调控,解决传统工艺通量低、一致性差的问题,实现质量均一LNPs的规模化制备。

图例3:CA/SAR微通道和CA/SAR/C1生产质量稳定的LNP的扩展策略
4.候选圆形SAR微通道结构及混合行为模拟图
研究团队呈现三种主副通道宽度比(1:1、2:1、3:1)的微通道构型(Type A/B/C),模拟不同雷诺数下的流体混合状态,并展示CA/SAR/C1芯片的内部通道结构,为筛选高效混合微通道提供结构依据。
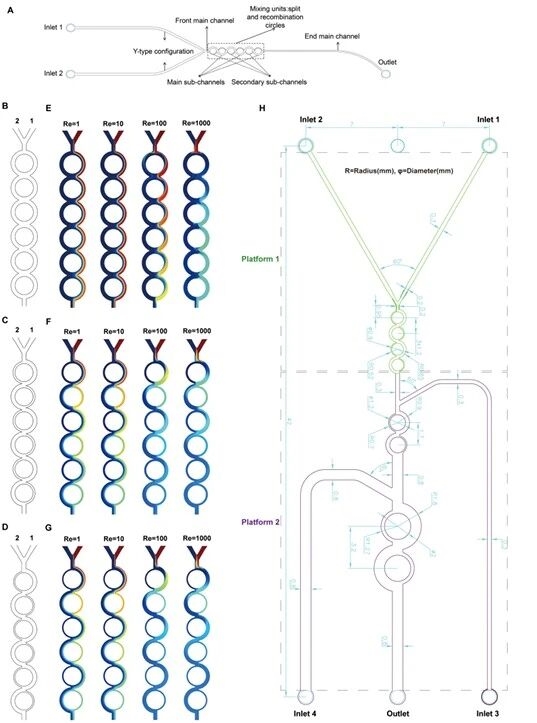
图例4:候选圆形SAR微通道结构及混合行为模拟图
5.微通道网格独立性验证及混合效率分析图
研究团队进一步通过验证不同网格精度下通道截面的浓度和流速分布,确定最优计算网格;对比三种微通道的混合指数、压力降和混合成本效率,明确Type C的混合成本效率最低,为后续实验提供理论支撑。
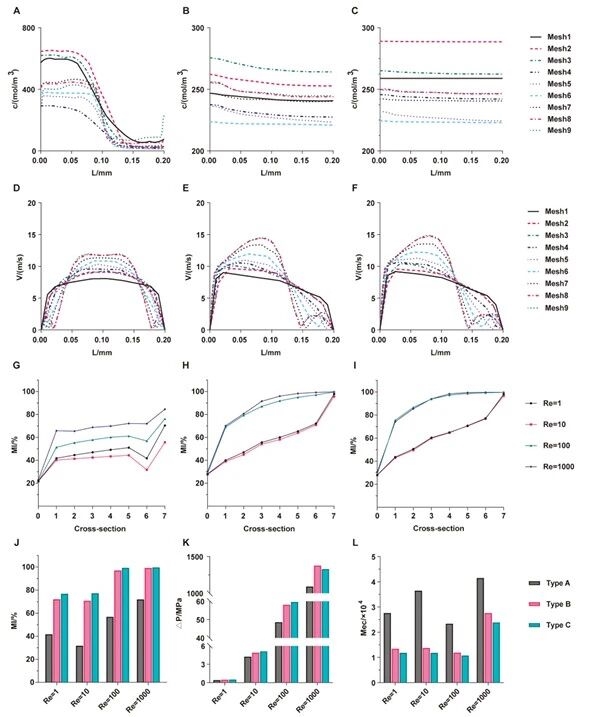
图例5:微通道网格独立性验证及混合效率分析图
6.三种微通道在不同循环次数的混合性能对比图
对比Type A/B/C在不同雷诺数、不同循环次数下的混合效果,证实CA/SAR结构的Type B/C混合效率优于CS/SAR结构的Type A,其中Type C在雷诺数大于100时仅需3个循环即可实现完全混合。
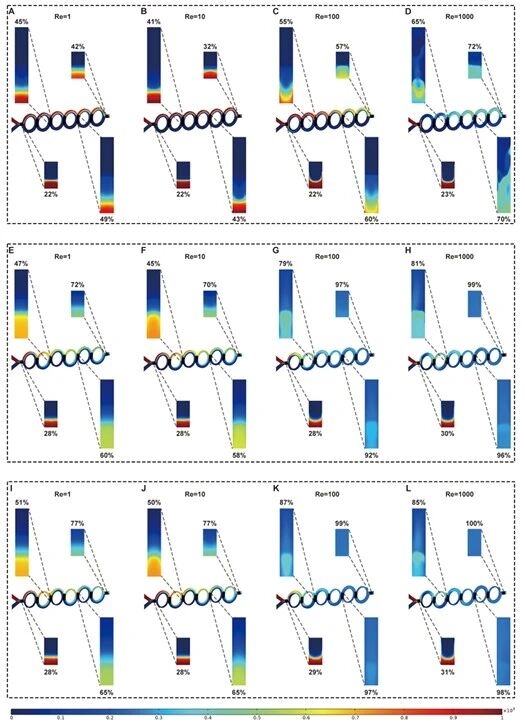
图例6:三种微通道在不同循环次数的混合性能对比图
7.Type C微通道模拟与实验结果验证及LNPs形态对比图
在前面实验的基础上,研究团队通过对比Type C微通道内乙醇-水两相混合的模拟与实验结果,验证模拟参数准确性;通过观察siGSDMD-LNPs制备过程中的混合状态,对比Type C、SHM、TrM制备的LNPs粒径和形态,证实Type C制备的LNPs粒径更小、均一性更好。

图例7:Type C微通道模拟与实验结果验证及LNPs形态对比图
8.siRNA序列筛选及siGSDMD-LNPs理化性质与稳定性表征图
研究团队进一步筛选出沉默效率最高的siGSDMD#3序列;通过表征siGSDMD-LNPs的粒径、电位和形态,验证其在PBS、血清、血浆中的稀释稳定性及4℃储存9个月的长期稳定性,确定性能稳定的siGSDMD-LNPs制备方案。
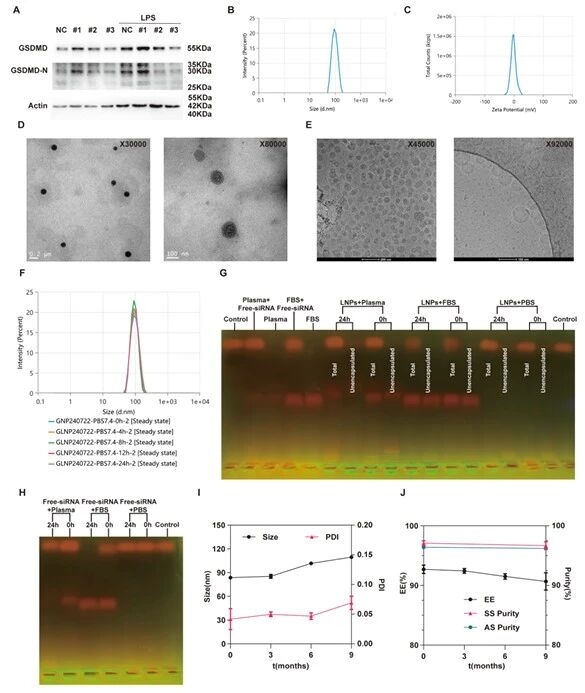
图例8:siRNA序列筛选及siGSDMD-LNPs理化性质与稳定性表征图
9.siGSDMD-LNPs在BMDMs中的细胞摄取与溶酶体逃逸验证图
在确定siGSDMD-LNPs制备方案后,研究团队为验证该纳米粒的体内作用机制,通过检测不同时间点LNPs在骨髓来源巨噬细胞(BMDMs)内的摄取效率,验证出LNPs对细胞活力无显著影响的结论;观察到siRNA在6小时可从溶酶体释放至细胞质,证实LNPs具备高效细胞摄取和溶酶体逃逸能力。
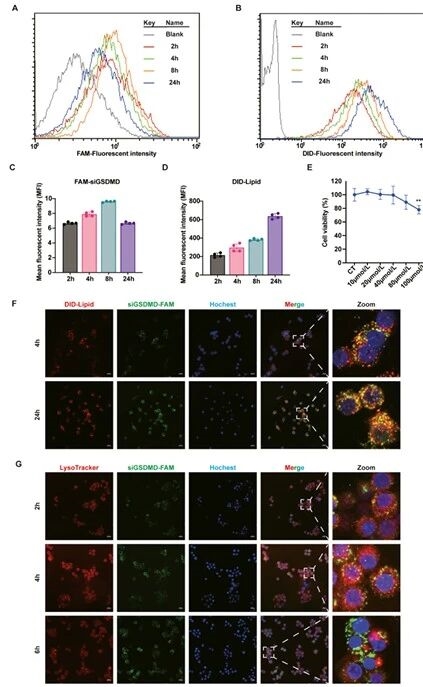
图例9:siGSDMD-LNPs在BMDMs中的细胞摄取与溶酶体逃逸验证图
10.siGSDMD-LNPs在BMDMs中抑制GSDMD表达及炎症因子分泌的验证图
在经典/非经典焦亡模型中,检测到LNPs可显著抑制GSDMD及GSDMD-N蛋白表达,下调炎症因子的mRNA水平和分泌量,在细胞层面证实其靶向沉默 GSDMD、抑制炎症反应的效果。
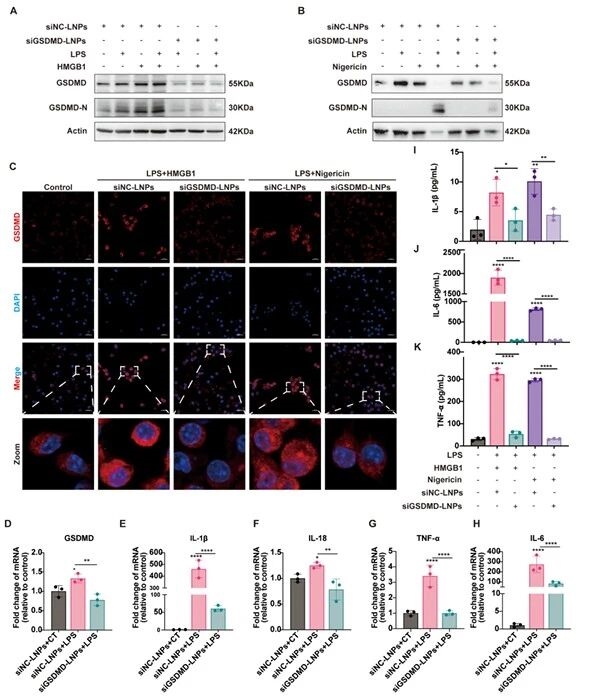
图例10:siGSDMD-LNPs在BMDMs中抑制GSDMD表达及炎症因子分泌的验证图
11.siGSDMD-LNPs 经肺部递送后的体内组织分布验证图
进一步地,研究团队通过活体和离体器官成像,发现LNPs经肺部递送后主要富集于肺组织,且滞留时间长于游离siRNA,明确其肺部靶向递送特征。
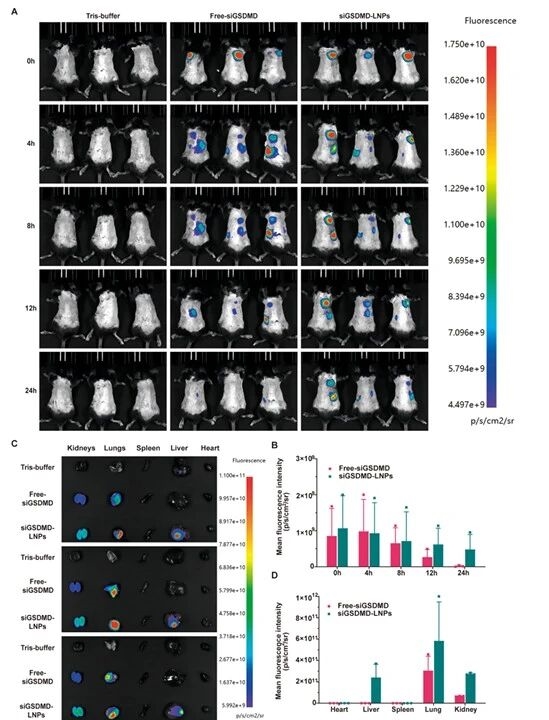
图例11:siGSDMD-LNPs 经肺部递送后的体内组织分布验证图
12.siGSDMD-LNPs 缓解脓毒症小鼠肺部炎症及提高生存率的验证图
研究团队通过设计小鼠体内给药的实验方案,检测到脓毒症小鼠血浆炎症因子水平降低,肺组织GSDMD表达及炎症因子mRNA水平下调,肺组织病理损伤减轻;生存曲线证实siGSDMD-LNPs可显著提高脓毒症小鼠的生存率。
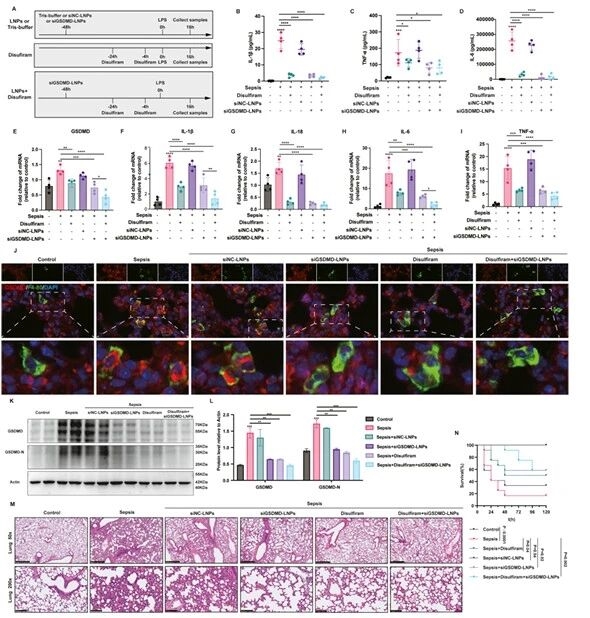
图例12:siGSDMD-LNPs 缓解脓毒症小鼠肺部炎症及提高生存率的验证图
13.siGSDMD-LNPs 缓解脓毒症小鼠肝肾损伤的验证图
研究团队检测到给予siGSDMD-LNPs后的脓毒症小鼠中肝肾组织中的GSDMD表达及炎症因子水平降低,肝肾组织病理损伤减轻,证实siGSDMD-LNPs对脓毒症所致多器官损伤具有保护作用。

图例13:siGSDMD-LNPs缓解脓毒症小鼠肝肾损伤的验证图
知识分享:研究亮点
本研究通过优化微流控芯片设计制备出性能优异的siGSDMD-LNPs,经肺部递送后可靶向沉默的GSDMD,阻断焦亡通路,减轻脓毒症引发的多器官损伤,为脓毒症治疗提供了新策略。
参考文献:
Nano Today ( IF 13.2 ) Pub Date:2025-01-30,DOI: 10.1016/j.nantod.2025.102653.
 欢迎来到苏州艾特森制药设备有限公司网站!
欢迎来到苏州艾特森制药设备有限公司网站! 欢迎来到苏州艾特森制药设备有限公司网站!
欢迎来到苏州艾特森制药设备有限公司网站!













